მოლეკულურ-კინეტიკური თეორიას უწოდებენ სწავლებას ნივთიერების აგებულებისა და თვისებების შესახებ, რომელსაც საფუძვლად უდევს წარმოდგენა, რომ ატომები და მოლეკულები ქიმიური ელემენტების უმცირეს შემადგენელი ნაწილაკებს წარმოადგენენ.
მოლეკულურ-კინეტიკური თეორიის საფუძველს სამი ძირითადი დებულება წარმოადგენს:
1) ყველა ნივთიერება -თხევადი, მაყარი და აირები - შედგება უმცირესი ნაწილაკების - მოლეკულებისგან, რომლების თვითონ ატომებისგან შედგებიან („ელემენტარული მოლეკულები“). ქიმიური ელემენტების მოლეკულები შეიძლება იყოს მარტივი და რთული, ე.ი შედგებოდეს ერთი ან რამდენიმე ატომისგან. მოლეკულები და ატომები ელექტრულად ნეიტრალურ ნაწილაკებს წარმოადგენენ. გარკვეულ პირობებში მოლეკულებს და ატომებს შუძლეათ შეიძინონ დამატებითი ელეტრული მუხტი და გადაიქცნენ დადებით ან უარყოფით იონებად.
2) ატომები და მოლეკულები მუდმივ, ქაოსურ მოძრაობაში არიან.
3) ნაწილაკები ერთმანეთთან ურთიერთქმედებენ ძალებით. რომლებსაც ელექტრული ბუნება აქვთ. ნაწილაკებს შორის გარავიტაციული ურთიერთქმედება იმდენად უმნიშვნელოა,რომ შესაძლებელია უგულვებელყოფა.

ნახ.1.
ბროუნის ნაწილაკების ტრაექტორიები
ატომებისა და მოლეკულების ქაოსური მოძრაობის შესახებ მოლეკულურ-კინეტიკური თეორიის წარმოდგენის საუკეთესო ექსპერიმენტულ დასაბუთებას ბროუნის მოძრაობა წარმოადგენს.

იგი სითხესა და აირში შეწონილი უმცირესი მიკროსკოპული ნაწილაკების სითბური მოძრაობაა. აღმოაჩინა ინგლისელმა ბოტანიკოსმა ბროუნმა 1927 წ. ბროუნის ნაწილაკები მოძრაობენ მოლეკულებთან უსასრულო შეჯახებების ხარჯზე. მოლეკულების ქაოსური სითბური მოძრაობის გამო ეს დაჯახებები არასოდეს არ აწონესწორებენ ერთმანეთს. ამის შედეგად ბროუნის ნაწილაკების სიჩქარეები უწესრიგოდ იცვლიან სიდიდესა და მიმართულებას, მათი ტრაექტორიები კი რთულ, ზიგზაგებისგან შედგენილ მრუდებს წარმოადგენენ (ნახ.1.). ბროუნის მოძრაობის თეორია აინშტაინის მიერ იქნა შექმნილი 1905წ. ანშტაინის თეორია ექსპერიმენტულად დაადასტურა ფრანგმა ფიზიკოსმა პერენმა 1908-1911წწ.
ანშტაინის თეორიის მთავარი დასკვნა იმაში მდგომარეობს, რომ ბროუნი ნაწილაკს საწყისი მდებარეობიდან წანაცვლების კვადრატი \(<r^{2}>\)E , რომელიც მრავალი ბროუნის ნაწილაკის წანაცვლების გასაშუალოებითაა მიღებული, დაკვირვების \(t\) დროის პროპორციულია.
\(<r^{2}>=Dt.\)
ეს ფორმულა ე.წ. დიფუზურ კანონს გამოსახავს. თეორიის მოხედვით \(D\) კოეფიციენტი ტემპერეტურის ზრდასთან ერთად მონოტონურად იზრდება.
მოლეკულების მუდმივი ქაოსური მოძრაობა თავს იჩენს აგრეთვე, სხვა ადვილად დაკვირვებად მოვლენეში, რომელსაც დიფუზია წოდება.
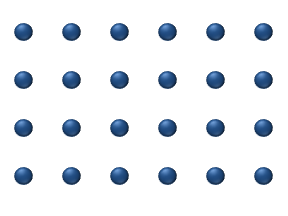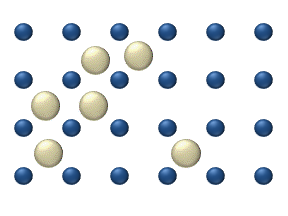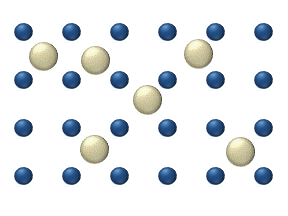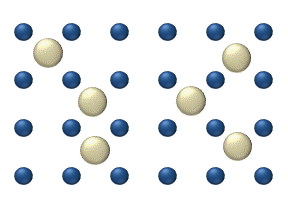
დიფუზია ეწოდება ორი ან რამოდენიმე ურთიერთშეხებაში მყოფი ნივთიერების ერთმანეთში შეღწევის მოვლენას. ყველაზე სწრაფად ეს პროცესი ისეთ აირში მიმდინარეობს, რომელის შედგენილობის მხრივ არაერთგვაროვანია. კომპონენტების სიმკვრივის მიუხედავად დიფუზიის შედეგად ერთგვაროვანი ნარევი მიიღება. მაგალითად, თუ გადატიხრული ჭურჭლის ორ ნაწილში იმყოფება ჟანგბადი \(O_{2}\) და წყალბადი \(H_{2}\), ტიხრის მოშორების შემდეგ იწყება ერთმანეთში შეღწევის პროცესი, რასაც ფეთქებადსაშიში ნარევის მიღება მოჰყვება. ეს პროცესი მაშინაც მიმდინარეობს, როცა მსუბუქი აირი (წაყალბადი) ჭურჭლის ზედა ნახევარში იმყოფება, უფრო მძიმე კი ქვედა.
სითხეებში ეს პროცესი გაცილებით ნელა მიმდინარობს. ორი სხვადასხვაგვარი სითხის ურთიერთშეღწევა, მყარი ნივთიერების სითხეში გახსნა (მაგ: შაქარი წყალში) და ერთგვაროვანი ხსნარის წარმოქმნა - სითხეში დიფუზიის მაგალითებია.
რეალურ პირობებში დიფუზია აირებსა და სითხეებში შენიღბულია უფრო ჩქარი შერევის პროცესებით, მაგალითად, კონვექციური დინებების წარმოქმნის გამო.
დიფუზიის ყველაზე ნელი პროცესი მყარ სხეულებში მიმდინარეობს. მაგრამ, ცდები უჩვენებენ, რომ კარგად გაპრიალებული ორი მეტალური ზედაპირის ხანგრძლივი კონტაქტის შედეგად ორივეში შეიძლება აღმოვაჩინოთ მეორე მეტალის ატომები.
დიფუზია და ბროუნის მოძრაობა მსგავსი მოვლენებია. შეხებაში მყოფი ნივთიერებების ურთიერთშეღწევა და სითხესა და აირში შეწონილი უმცირესი ნაწილაკების ქაოსური მოძრაობა მოლეკულების სითბური ქაოსური მოძრაობის შედეგია.
ორ მოლეკულას შორის მოქმედი ძალა მათ შორის მანძილზეა დამოკუდებული. მოლეკულები რთულ სივრცულ სტრუქტურებს წარმოადგენენ, რომლებიც როგორც დადებით, ასევე უარყოფით იონებს შეიცავენ. თუ მოლეკულებს შორის მანძილი საკმარისად დიდია, მაში მოლეკულებს შორის მიზიდულობის ძალები ჭარბობს, მცირე მანძილებზე კი ჭარბობს განზიდვის ძალები. ჯამური F ძალისა და მოლეკულებს შორის ურთიერთქმედების პოტენციური ენერგიის \(E_{p}\) სიდიდეებიდან დამოკუდებულება მოლეკულების ცენტრებს შორის მანძილებძე ნაჩვენებია ნახ. 2-ზე. რაღაც \(r=r_{0}\) მანძილზე ურთიერთქმედების ძალა ნულის ტოლი ხდება. ეს მანძილი, პირობითად, შეიძლება მივიღით მოლეკულის დიამეტრის ტოლად. ურთიერთქმედების პოტენციური ენერგია \(r=r_{0}\) -სთვის მინიმალურია. ერთმანეთისგან \(r_{0}\) მანძილეზე მყოფი ორი მოლეკულის ერთმანეთისგან დასაცილებლად მათ უნდა მივანიჭოთ დამატებითი ენერგია \(E_{0}.\) \(E_{0}\) სიდიდეს პოტენციური ორმოს სიღრმეს ან კავშირის ენერგიას უწოდებენ.

ნახ. 2.
ორი მოლეკულის ურთიერთქმედების \(F\) ძალა და ურთიერთქმედების პოტენციური \(E_{p}\) ენერგია. \(F>0\)– განზიდვის ძალა, \(F<0\) – მიზიდვის ძალა.
მოლეკულებს უკიდურესად მცირე ზომები აქვთ. მარტივი, ერთატომიანი მოლეკულების ზომები 10–10 მ რიგისაა. რთულ, მრავალატომიან მოლეკულებს შეიძლება ჰქონდეთ ასობით და ათასობით უფრო დიდი ზომები.
მოლეკულების მოუწესრიგებელ ქაოსურ მოძრაობას სითბურ მოძრაობას უწოდებენ. სითბური მოძრაობის კინეტიკური ენერგია ტემპერატურის ზრდით იზრდება. დაბალი ტემპერატურებისთვის მოლეკულების საშუალო კინეტიკური ენერგია შეიძლბა პოტენციური ორმოს \(E_{0}\) სიღრმეზე დაბლა აღმოჩნდეს. ასეთ სემთხვევასი მოლეკულები კონდენსირდებიან თხევად ან მყარ ნივთიერებად; ამასთან მოლეკულებს შორის საშუალო მანძილი დახლოებით r0-ის ტოლია. ტემპერატურის გაზრდისას მოლეკულების საშუალო კინეტიკური ენერგია \(E_{0}\)-ს აჭარბებს, მოლეკულები იფანტებიან, და წარმოიქმნება აირადი ნივთიერება.
მყარ სხეულებშო მოლეკულები ქაოსურ მოძრაობას ასრულებენ ფიქსირებული ცენტრების (წონასწორობის ადგილების) მახლობლობაში. ეს ცენტრები სივრცეში შეიძლება არარეგულარულად იყვნენ განლაგებული (ამორფული სხეულები) ან ქმნიდნენ მოწესრიგებულ მოცულობით სტრუქტურებს (კრისტალური სხეულები).
სითხეებში მოლეკულებს მნიშვნელოვნად დიდი თავისუფლება აქვთ სითბური მოძრაობისთვის. ისინ გარკვეულ ცენტრებთან არ არიან დაკავშირებული და შეუძლიათ გადაადგილება სითხის მთელ მოცულობაში. ამითი აიხსნება სითხეების დენადობა. ახლომდებარე სითხის მოლეკულებსაც შეუძლიათ წარმოქმნან რამდენიმე მოლეკულისგან შემდგარი მოწესრიგებული სტრუქტურები. ამ მოვლენას ახლო წესრიგს უწოდებენ, კრისტალური სხეულებისათვის დამახასიათემელი შორი წესრიგისგან განსხვავებით.
აირებში მოლეკულებს შორის მანძილი, ჩვეულებრივ მნიშვნელოვნად მეტია მათ ზომებზე. მოლეკულებს შორის ურთიერთქმედების ძალები ასეთ დიდ მანძილებძე მცირეა, და ყოველი მოლეკულა წრფის გასწვრივ მოძრაობს სხვა მოლეკულასთან ან ჭურჭლის კედელთან შემდგომ დაჯახებამდე. ნორმალურ პირობებში ჰაერის მოლეკულებს შორის საშუალო მანძილი 10–8 რიგისაა, ე.ი. ათეულობით აჭარბებს მოლეკულების ზომებს. მოლეკულებს შორის სუსტი ურთიერთქმედებით აიხსნება აირების გაფართოების და ჭურჭლის მთელი მოცულობის დაკავების თვისება. ზღვარზე, სადაც ურთიერთქმედება ნულისკენ მიისწრაფის, ჩვენ მივდივართ იდეალური აირის წარმოდგენამდე.
მოლეკულურ-კინეტიკურ თეორიაში ნივთიერების რაოდენობა ნაწილაკების რიცხვის პროპორციულადაა მიღებული. ნივთიერების რაოდენობის ერთეულს მოლი ეწოდება.
მოლი - ნივთიერების ის რაოდენობაა, რომელიც იმდენივე ნაწილაკს (მოლეკულას) შეიცავს, რამდენ ატომსაც შეიცავს 0,012 კგ ნახშირბადი \(^{12}C\). ნახშირბადის მოლეკულა ერთი ატომისაგან შედგება.
ამგვარად, ნებისმიერი ნივთიერების ერთი მოლი შეიცავს ერთიდაიგივე ნაწილაკების (მოლეკულების) რაოდენობას. ამ რიცხვს ავოგადროს მუდმივას \(N_{A}\) უწოდებენ:
\(N_{A}=6,02\cdot 10^{23}\) მოლი–1
ავოგადოს მუდმივა - მოლეკულურ-კინეტიკური თეორიის ერთ-ერთი უმნიშვნელოვანესი მუდმივაა.
ნივთიერების რაოდენობა \(\nu\) განისაზღვრება როგორც ნაწილაკების (მოლეკულების) რიცხვის \(N\) ფარდობა ავოგადროს \(N_{A}\) მუდმივასთან:
\(\nu=\frac{N}{N_{A}}.\)
ერთი მოლი ნივთიერების მასას \(M\) მოლურ მასას უწოდებენ. მოლერი მასა ტოლია ნივთიერების ერთი მოლეკულის მასის ნამრავლისა ავოგადროს მუდმივაზე:
\(M=N_{A}\cdot m_{0}.\)
მოლური მასა გამოისახება კგ/მოლი სიდიდით. ერთი ატომისაგან შედგენილი მოლეკულების მქონე ნივთიერებისათვის ხშირად იყენებეს ტერმინს ატომური მასა.
ატომებისა და მოლეკულების მასის ერთეულად მოღებულია ნახშირბადის \(^{12}C\) იზოტოპის (მასური რიცხვი 12) ატომის მასის 1/12. ამას მასის ატომურ ერთეულს უწოდებენ.
1 მ.ა.ე. = 1,66·10–27 კგ.
ეს სიდიდე თითქმის ემთხვევა პროტონის ან ნეიტრონის მასას. მოცემული ნივთიერების ატომის ან მოლეკულის მასის ფარდობას 12C ნახშირბადის ატომის მასის 1/12-თან ფარდობით მასას უწოდებენ.