თხევად მდგომარეობაში მყოფი ნივთიერების მოლეკულები თითქმის მიჯრითაა ერთმანეთზე მიწყობილი. მყარი კრისტალური სხეულებისგან განსხვავებით, სადაც მოლეკულები კრისტალის მთელ მოცულობაში მოწესრიგებულ სტრუქტურებს ქმნიან და სითბური რხევის შესრულება მხოლოდ ფიქსირებული ცენტრების მახლობლად შეუძლიათ, სითხის მოლეკულებს დიდი თავისუფლება აქვთ. სითხის ყოველი მოლეკულა, ისევე როგორც მყარ სხეულში, ყველა მხრიდან „მომწყვდეულია“ მეზობელი მოლეკულებით და სითბურ რხევას ასრულებენ გარკვეული წონასწორობის მდებარეობის მახლობლობაში. მაგრამ, დროდადრო ნებისმიერ მოლეკულას შეუძლია გადაადგილდეს მეზობელ ვაკანტურ (ცარიელ) ადგილზე. სითხეებში ასეთი გადახტომები საკმაოდ ხშირად ხდება: ამიტომ მოლეკულები, კრისტალებისგან განსხვავებით, არა რიან მიბმული გარკვეულ ცენტრებთან, და შეუძლიათ მოძრაობა სითხის მთელ მოცულობაში. ამით აიხსნება სითხეების დენადობა. ახლომდებარე მოლეკულების ძლიერი ზემოქმედების გამო, მათ შეუძლიათ რამოდენი მოლეკულისგან შემდგარი, ლოკალური, არამდგრადი მოწესრიგებული ჯგუფების შექმნა. ამ მოვლენას ახლო წესრიგს უწოდებენ (ნახ. 1).

ნახ. 1.
სითხეების ახლო წესრიგისა და კრისტალების შორი წესრიგის მაგალითი: 1 -წყალი; 2 - ყინული.
ნახ. 2-ზე წყლის მაგალითზე ნაჩვენებია აირადი ნივთიერების განსხვავება სითხისგან. წყლის მოლეკულა \(H_{2}O\) შედგება ერთმანეთისადმი 104° გუთხით განლაგებული, ჟანგბადის ერთი ატომისა და წყალბადის ორი ატომისგან. ორთქლის მოლეკულებს შორის საშუალო მანძილი ათეულობით აღემატება წყლის მოლეკულებს შორის საშუალო მანძილს. ნახ. 1 ნახაზისაგან განსხვავებით, სადაც წყლის მოლეკულები ბურთულების სახითაა გამოსახული, ნახ. 2 წყლის მოლეკულის სტრუქტურაზე წარმოდგენას იძლევა.
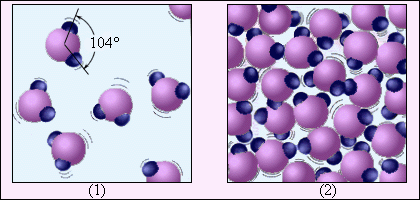
ნახ. 2.
წყლის ორთქლი (1) და წყალი (2). წყილ მოლეკულები დაახლოებით 5·107 -ჯერაა გადიდებული.
მოლეკულების მჭიდრო განლაგების სითხეების კუმშვადობა, ე.ი. წნევის ცვლილებით მოცულობის ცვლილება , ძალიან მცირეა: ათეულ და ასეულჯერ ნაკლებია აირებთან შედარებით. მაგალითად. წყლის მოცულობის 1 % -ით შესაცვლელად წნევა დაახლოებით 200-ჯერ უნდა გაიზარდოს. წნევის ასეთი სიდიდე ატმოსფერულთან შედარებით 2 კმ სიღრმეზე მიიღწევა.
სითხეები, მყარი სხეულიბის მსგავსად, ტემპერატირის ცვლილებისას იცვლიან მოცულობას. ტემპერატურის მცირე ინტერვალებისთვის მოცულობის ფარდობითი ცვლილება \(\frac{\Delta V}{V_{0}}\) ტემპერატირის \(\Delta T\) ცვლილების პროპორციულია:
\(\frac{\Delta V}{V_{0}}=\beta\Delta T.\)
\(\beta\) კოეფიციენტს მოცულობითი გაფართოების კოეფიციენტს უწოდებენ. ეს კოეფიციენტი სითხეებისათვის ათეულობითჯერ აღემატება მყარი სხეილების კოეფიციენტს. წყლისთვის, მაგალითად, 20 °С ტემპერატურისათვის β ≈ 2·10–4 K–1, ფოლადისათვის β ≈ 3,6·10–5 K–1, კვარცის მინისათვის β ≈ 9·10–6 К–1.
წყლის ტემპერატურულ გაფართოებას დედამიწეზე ცხოვრებისთვის საინტერესი და მნიშვნელოვანი ანომალია აქვს. 4 °С -ზე დაბალი ტემპერატურებისთვის წყალი ტემპერატურის შემცირებისას ფართოვდება (β < 0). წყალს მაქსიმალური სიმკვრივე ρ = 103 кг/м3 , 4 °С ტემპერატურაზე აქვს.
გაყინვისას წყალი ფართოვდება, ამიტომ წყალსატევის გაყინვისას ყინული ზედაპირზე ცურავს. წყლის გაყუნვის ტემპერატურა 0 °С-ია. წყლის უფრო მკვრივ ფენებში, წყალსატევების ფსკერზე, წყლის ტემპერატურა 4 °С-რიგისაა. ამის გამო სიცოცხლეს შეუძლია არსებობა ისეთ წყალსატევებში, რომლებიც მთლიანად არ იყინება.
სითხეების განსაკუთრებით საინტერესო თვოსებას თავისუფალი ზედაპირის არსებობა წარმოადგენს. სითხეები, აირებისაგან განსხვავებით, არ ავსებენ ჭურჭელს რომლებშიც არიან ჩასხმული. სითხესა და აირს (ან ორთქლს) შორის წარმოიქმნება საზღვარი, რომელიც სითხის დანარჩენ მასასთან შედარებით განსაკუთრებულ მდგომარეობაში იმყოფება. ამ საზღვრის მიმდებარე ფენის სითხის მოლეკულები, უფრო ღრმა ფენებში მყოფი მოლეკულებისაგან განსხვავებით, იგივე სითხის მოლეკულებით ყველა მხიდან არაა გარშემორტყმული. სითხის შიგნით ერთ მოლეკულაზე მეზობელი მოლეკულების მხრიდან მომქმედი მოლეკულური ურთიერთქმედების ძალები საშუალოდ ურთიერთკომპენსირებულია. სასაზღრო ფენაში მყოფი ყოველი მოლეკულა სითხეში მყოფი მოლეკულების მიერ მიიზიდება (სითხის ამ მოლეკულაზე აირის (ამ ორთქლის) მხრიდან მომქმედი ძალები შეიძლება უგულვებელვყოთ). შედეგად მიიღება რაღაც ტოლქმედი ძალა, რომელიც სითხის შიგნითაა მიმართული. ძედაპირული მოლეკულები მოლეკულათშორისი მიზიდულობის ძალების მოქმედებით გადაადგილდებიან სითხის სიღრმეში. მაგრამ, ყველა მოლეკულა, მათ შორის სასაზრვრო ფენის მოლეკულებიც, უნდა იმყოფებოდნენ წონასწორობის მდგომარეობაში. ეს წონასწორობა მიიღწება სასაზღვრო ფენის მოლეკულებსა და სითხის სიღრმეში მათ უახლოეს მეზობლებს შორის მანძლილის შემცირებით.როგორც ნახ. 2-დან ჩანს, მოლეკულებს შორის მანძილის შემცირებისას აღიძვრება განზიდვის ძალები. თუ სითხის შოგნით მოლეკულებს შორის საშუალო მანძილი r0 ტოლია. მაშინ ზედაპირული ფენის მოლეკულები უფრო მჭიდროდაა განლაგებული. ამიტომაც მათ პოტენციური ენერგიის დამატებითი მარაგი აქვთ სითხეში მდებარე მოლეკულებთან შედარებით (იხ. ნახ. 2). უნდა გვახსოვდეს, რომ სითხეების ძნელად კუმშვადობის გამო უფრო მჭიდროდ განლაგებული ზედაპირული მოლეკულების გამო სითხის მოცულობის რაიმე შესამჩნევ ცვლილებას ადგილი არ ქავს. თუ მოლეკულა ზედაპირიდან სიღრმისაკეს ინაცვლებს, მოლეკულათა შორისი ურთიერთქმედების ძალები ასრულებენ დადებით მუშაობას. და პირიქით, სიღრმიდან რამოდენიმე მოლეკულის ზედაპირზე ამოსაყვანად (ე.ი. რომ გავზარდოთ ზედაპირის ფართობი) გარე ძალებმა უნდა შეასრულოს ზედაპირის ფართობის ΔS ცვლილების პროპორციული დადებითი მუშაობა ΔAგარე :
ΔAგარე = σΔS.
პროპორციულობის σ კოეფიციენტს ზედაპირული დაჭიმულობის კოეფიციენტს უწოდებენ (σ > 0). ამგვარად, ზედაპირული დაჭიმულობის კოეფიციენტი იმ მუშაობის ტოლია, რომელის საჭიროა მუდმივი ტემპერატურის პირობებში ზედაპირის ფართობის ერთი ერთეულით გაზრდისათვის.
სი სისტემაში ზედაპირული დაჭიმულობის კოეფიციენტი იზომება ჯოული/მ2 ან ნ/მ2-ით.
აქედან გამომდინარე. ზედაპირული ფენის მოლეკულებს სითხის შიგნით მყოფ მოლეკულებთან შედარებით ჭარბი პოტენციური ენერგია აქვს. სითხის ზედაპირის პოტენციური ენერგია ზედაპირის ფართობის პროპორციულია:
Eр = Aგარე = σS.
მექანიკიდან ცნობილა, რომ სისტემოს წონასწორულ მდგომარეობას პოტენციური ენერგიის მინიმალური მნიშვნელობა შეესაბამება. აქედან გამომდინარე, სითხის თავისუფალი ზედაპირი ცდილობს შეამციროს თავისი ფართობი. ამ მიზეზით სითხის თავისუფალი წვეთი სფეროსებურ ფორმას ღებულობს. სითხე ისე იქცევა, თითქოს მისი ზედაპირის მხების გასწვრივ მოქმედებს ამ ზედაპირის მომჭიმავი (შემკუმშავი, შემამცირებელი) ძალები. ამ ძალებს ზედაპირული დაჭიმულობის ძალები ეწოდება.

ზედაპირული ძალების არსებობა სითხის ზედაპირს დრეკადი გადაჭიმული აპკის მაგვარს ხდის, იმ განსხვავებით, რომ აპკის დრეკადი ძალები დამოკიდებულია მისი ზედაპირის ფართობზე (ე.ი. თუ როგოორაა აპკი დეფორმირებული), ხოლო ზედაპირული დაჭიმულობის ძალები სითხის ზედაპირის ფართობზე არ არიან დამოკიდებული.
ზოგიერთ სითხეს, მაგალითად, საპნიან წყალს, ახასიათებს თხელი აპკის შექმნის უნარი. ყველასთვის კარგად ცნობილი საპნის ბუშტებს სფერული ფორმა აქვთ - ამაშიც ზედაპირული დაჭიმულობის ძალების მოქმედება ვლინდება. თუ საპნის ხსნარში ჩაუშვებთ მავთულის ჩარჩოს. რომლის ერთ მხარეს მოძრაობა შეუძლია, იგი სითხის აპკით დაიფარება. (ნახ. 3).
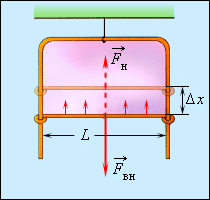
ნახ. 3.
ჩარჩოს მოძრავი მხაერე წონასწორობაშია გარე \(\vec{F_{g}}\) ძალისა და ზედაპირული დაჭიმულობის \(\vec{F_{d}}\) ძალების ტოლქმედის ზემოქმედების შედეგად.
ზედაპირული დაჭიმულობის ძალები ცდილობენ შეამცირონ აპკის ზედაპირი. ჩარჩოს მოძრავი მხარის წონასწორობისთვის მას უნდა მოვდოთ გარე ძალა \(\vec{F_{g}}=-\vec{F_{d}}\) თუ \(\vec{F_{g}}\) ძალის მოქმედებით ეს გვერდი გადაადგილდა \(\Delta x\)-თი, მაშინ შესრულდა მიშაობა \(\Delta A_{g}=F_{g}\Delta x=\Delta E_{p}=\sigma \Delta S\), სადაც \(\Delta S=2L\Delta x\) – საპნის აპკის ორივე მხარის ზედაპირი ფართობის ნაზრდია. რადგანაც \(\vec{F_{g}}\) და \(\vec{F_{d}}\)ძალების მოდულები ერთნაირია. შეიძლება ჩაიწეროს:
\(F_{d}\Delta x=\sigma2L\Delta x\) ან \(\sigma=\frac{F_{d}}{2L}.\)
ამგვარად. ზედაპირული დაჭიმულობის კოეფიციენტი σ შეიძლება განისაზღვროს როგორც, ზედაპირის შემომსაზღვრელი წრფის ერთეულ სიგრძეზე მომქმედი დაჭიმულობის ძალის მოდული.
ძედაპირული დაჭიმულობის ძალების მოქმედების გამო სითხის წვეთებში და საპნის ბუშტების შიგნით წარმოიქმნება ჭარბი წნევა \(\Delta p\). თუ წარმოვიდგენთ, რომ გავჭერით \(R\) რადიუსიანი სფერული წვეთი ორ ტოლ ნაწილად, თითოეული მათგანი გაჭრის \(2\pi R\) ტოლი სიგრძის საზღვარზე მოდებული ზედაპირული დაჭიმულობის ძალებისა და \(\pi R^{2}\) ფართობის მქონე კვეთაზე მომქმედი ჭარბი წნევის ძალების მოქმედების შედეგად უნდა იმყოფებოდეს წონასწორობაში (ნახ.4). წონასწორობის პირობები ასე ჩაიწერება:
\(\sigma2\pi R=\Delta p\pi R^{2}\)
აქედან გამომდინარე, წვეთის შიგნით ჭარბი წნევა ტოლია
\(\Delta p=\frac{2\sigma}{R}\)(სითხის წვეთი)

ნახ. 4.
სითხის სფერული წვეთის კვეთა
ჭარბი წნევა საპნის ბუშტის შიგნით ორჯერ მეტია, რადგან აპკს ორი ზედაპირი აქვს:
\(\Delta p=\frac{4\sigma}{R}\)(საპნის ბუშტი)
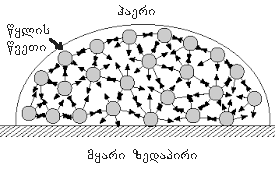
სითხის, მყარი სხეულისა და აირის საზღვრის მახლობლად სითხის თავისუფალი ზედაპირის ფორმა დამოკიდებულია სითხის მოლეკულების მყარი სხეულის მოლეკულებთან ურთიერთქმედების ძალებზე (აირის (ან ორთქლის) მოლეკულებთან ურთიერთქმედება შეიძლება უგულვებელყოთ). თუ ეს ძალები მეტია სითხის მოლეკულებს შორის ურთიერთქმედების ძალებზე, მაშინ სითხე ასველებს მყარი სხეულის ზედაპირს. ასეთ შემთხვევაში სითხე უახლოვდება მყარი სხეულის ზედაპირს გარკვეული θ მახვილი კუთხით, რომელიც ახასიათებს სითხე-მყარი სხეულის მოცემულ წყვილს. θ კუთხეს კიდის კუთხე ეწოდება. თუ სითხის მოლეკულებს შორის ურთიერთქმედების ძალები სითხის მოლეკულების მყარი სხეულის მოლეკულებთან ურთიერთქმედების ძალებზე მეტია, მაშინ კიდის კუთხე θ ბლაგვია (ნახ. 5).ამ შემთხვევაში ამბობენ, რომ სითხე არ ასველებს მყარი სხეულის ზედაპირს. სრული დასველებისას θ = 0, სრული არდასველებისას θ = 180°.
ნახ. 5.
დამასველებელი (1) და არადამასველებელი (2) სითხეების მრუდე კუთხეები.
კაპილარული მოვლენა ეწოდება მცირე დიამეტრის მილებში - კაპილარებში, სითხის აწევას ან დაშვებას. დამასველემელი სითხეები კაპოლარებში ზევით იწევენ, არადამასველებლები კი ქვევით ეშვებიან.
ნახ. 6-ზე გამოსახულია ქვედა ბოლოთი ρ სიმკვრივის სითხეში დამასველებელ სითხეში ჩაშვებული, r რაღაც რადიუსის კაპილარული მილი. კაპილარის ზედა ბოლო ღიაა. კაპილარში სითხის აწევა მანამდე გრძელდება, სანამ კაპილარში სითხის სვეტზე მომქმედი Fსიმძ სიმძიმის ძალა მოდულით არ გაუტოლდება ჯამურ დაჭიმვის Fდაჭ ძალას, რომელიც მოქმედებს კაპილარის კედელთან შეხების საზღვრის გასწვრივ: Fსიმძ = Fდაჭ, სადაც Fსიმძ = mg = ρhπr2g, Fდაჭ = σ2πr cos θ.
აქედან გამომდინარე:
\(h=\frac{2\sigma\cos\theta}{\rho gr}\)
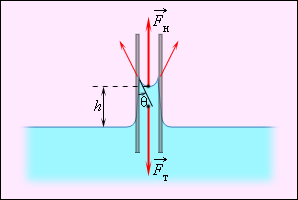
ნახ. 6.
კაპილარში დამასველებელი სითხის ასვლა
სრული დასველებისას θ = 0, cos θ = 1. ამ შემთხვევაში
\(h=\frac{2\sigma}{\rho gr}.\)
სრული არადასველებისას θ = 180°, cos θ = –1 და. ე.ი. h < 0. კაპილარში არადამასველებელი სითხის დონე დაბლა იწევს იმ ჭურჭელში სითხის დონესთან შედარებით, რომელშიაც ჩაშვებულია კაპილარი.
წყალი პრაქტიკულად მთლიანად ასველებს მინის სუფთა ზედაპირს. ვერცხლისწყალი, პირიქით სულ არ ასველებს მინის ზედაპირს. ამიტომ ვერცხლისწყლის დონე მინის კაპილარში უფრო დაბლა ეშვება, ვიდრე ჭურჭელში, რომელშიც კაპილარია ჩაშვებული.