ელექტროლიტებს უწოდებენ გამტარ გარემოს, რომელშიც ელექრული დენის გავლას თან ახლავს ნივთიერების გადატანა. ელექტროლიტებში თავისუფალი მუხტის მატარებლებს დადებითად და უარყოფითად დამუხტული იონები წარმოადგენენ. ელექტროლიტებს განეკუთვნებიან გამდნარ მდგომარეობაში მყოფი მარავალი მეტალის შენაერთი, და ასევე ზოგიერთი მყარი ნივთიერება. მაგრამ ელექტროლიტების ძირითად წარმომადგენლებს, რომლებსაც ფართოდ იყენებენ ტექნიკაში, არაორგანული მაჟავეების, მარილებისა და ფუძე წყალხსნარები წარმოადგენენ.
ელექტროლიტში ელექტრული დენის გავლას თან ახლავს ელექტროდებზე ნივთიერების გამოყოფა. ამ მოვლენას ელექტროლიზს უწოდებენ.
ელექტროლიტში ელექტრული დენი ორივე ნიშნის იონების ერთმანეთის საწინააღმდეგო მიმართულებით მოძრაობას წარმოადგენს. დადებითი იონები მოძრაობენ უარყოფითი ელექტროდისკენ (კათოდისკენ), უარყოითი იონები კი დადებითი ელექტროდისკენ (ანოდისკენ). იონები მჟავების, მარილებისა და ტუტეების წყალხსნარებში ნაწილი ნეიტრალური მოლეკულების გახლეჩვის შედეგად წარმოიქმნება. ამ მოვლენას ელექტრულ დისოციაციას უწოდებენ. მაგალითად, სპილენძის ქლორიდი, CuCl2 წყალხსნარში დისოცირდება სპილენძისა და ქლორის იონებად:
\(CuCl_{2}\rightleftharpoons Cu^{2+}+2Cl^{-}\)
ელექტროდების დენის წყაროსთან მიერთებისას ელექტრული ველის მოქმედებით იონები იწყებენ მოწესრიგებულ მოძრაობას: სპილენძის დადებითი იონების კათოდისკენ მიემართებიან, ხოლო ქლორის უარყოფითი იონები - ანოდისაკენ (ნახ. .1).
მიაღწევენ რა კათოდს სპილენძის იონები კათოდის ჭარბი ელექტრონებით ნეიტრალდებიან, ნეიტრალურ ატომებად გარდაიქმნებიან და ილექებიან კათოდზე. ქლორის იონები აღწევენ რა ანოდამდე, გასცემენ ერთ ელექტრონს. ამის შემდეგ ქლორის ნეიტრალური ატომები წყვილ-წყვილად ერთდებიან და ქმნიან ქლორის მოლეკულას Cl2. ანოდზე ქლორი ბუშტუკების სახით გამოიყოფა.
ბევრ შემთხვევაში ელექტროლიზს თან ახლავს ელექტროდებზე გამოყოფილი დაშლის პროდუქტების მეორადი რეაქცია ელექტროდების მასალასთან ან გამხსნელთან. მაგალითს წარმოადგენს სპილენძის სულფატის წყალხსანარის CuSO4 (სპილენძის კუპოროსის) ელექტროლიზი იმ შემთხვევაში, როცა ელექტროდები ჩაშვებულია სპილენძისაგან დამზადებულ ელექტროლიტში.
სპილენძის სულფატის მოლეკულების დისოციაცია შემდეგი სქემით ხდება
\(CuSO_{4}\rightleftharpoons Cu^{2+}+SO_{4}^{2-}\)
სპილენძის ნეიტრალური ატომები კათოდზე მყარი ნალექის სახით ედება. ამ გზით ქიმირად სუფთა სპილენძის მიღებაა შესაძლებელი. \(SO_{4}^{2-}\) იონი ანოდს აძლევს ორ ელექტრონს ნეიტრალურ რადიკალად SO4 გადაიქცევა და მეორად რეაქციაში შედის სპილენძის ანოდთან:
SO4 + Cu = CuSO4.
სპილენძის სულფატის წარმოქმნილი მოლეკულა ხსნარში გადადის.
ამგვარად, სპილენძის სულფატის წყალხსანარში ელექტრული დენის გავლისას ხდება სპილენძის ანოდის დაშლა და სპილენძის კათოდზე დალექვა. ამ დროს სპილენძის სულფატის კონცენტარცია არ იცვლება.
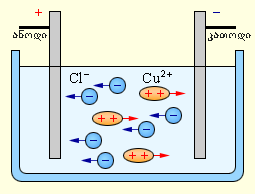
ნახ. 1.
სპილენძის ქლორიდის წყალხსნარის ელექტროლიზი
ელექტროლიზის კანონი ექსპერიმენტულად დაადგინა ინგლისელმა ფიზიკოსმა მ.ფარადეიმ 1833 წელს. ფარადეის კანონი განსაზღვრავს ელექტროლიზის დროს ელექტროდებზე გამოყოფილი პირველადი პროდუქტების რაოდენობას:
ელექტროდზე გამოყოფილი ნივთიერების m მასა ელექტროლიტში გატარებული Q მუხტის პირდაპირპროპორციულია:
m = kQ = kIt.
k სიდიდეს ელექტროქიმიურ ექვივალენტს უწოდებენ.
ელექტროდზე გამოყოფილი ნივთიერების მასა ყველა იმ იონის მასის ტოლია, რომლებმაც ელექტროდამდე მიაღწია:
\(m=m_{0}N=m_{0}\frac{Q}{q_{0}}=\frac{m_{0}}{q_{0}}It\)
აქ m0 და q0 - ერთი იონის მასა და მუხტია, \(N=\frac{Q}{q_{0}}\)- იონების რიცხვი, რომლებმაც ელექტროდამდე მიაღწია ელექტროლიტში Q მუხტის გავლისას. ამგვარად, ელექტროქიმიური ექვივალენტი k ტოლია მოცემული ნივთიერების იონის m0 მასის ფარდობისა მის q0 მუხტთან. რადგანაც იონის მუხტი ნივთიერების n ვალენტობის ელექმენტარული მუხტის e სიდიდეზე ნამრავლის ტოლია (q0 = ne), გამოსახულება ელექტროქიმიური ექვივალენტი k-სათვის შემდეგი სახით ჩაიწერება
\(k=\frac{m_{0}}{q_{0}}=\frac{m_{0}N_{A}}{neN_{A}}=\frac{1}{F}\frac{M}{n}\).
სადაც NA – ავoგადროს მუდმივაა, M = m0NA – ნივთიერების მოლეკულური მასა, F = eNA – ფარადეის მუდმივა.
F = eNA = 96485 კ / მოლი.
ფარადეის მუდმივა რიცხობრივად იმ მუხტის ტოლია, რომელმაც უნდა გაიაროს ელექტროლიტში ელექტროდზე ერთი მოლი ერთვალენტიანი ნივთიერების გამოსაყოფად.
ელექტროლიზისათვის ფარადეის კანონს აქვს სახე:
\(m=\frac{1}{F}\frac{M}{n}It\).
ელექტროლიტის მოვლენა თანამედროვე წარმოებაში fართოს გამოიყენება.